研究人员可能已经发现了大脑中连接所有神经退行性疾病的蛋白质团块背后的罪魁祸首。
所有神经退行性疾病都有一个共同的线索:大脑中蛋白质团块的出现,如阿尔茨海默病中的-淀粉样斑块和帕金森病中的-突触核蛋白聚集。
在对果蝇和小鼠进行的两项研究中,研究人员发现,沐鸣代理问题出在将蛋白酶体(一种分解蛋白质的分子机制)运输到细胞内特定位置的系统上。
洛克菲勒大学(Rockefeller University)教授赫尔曼•斯特勒(Hermann Steller)表示:“这是首次发现蛋白酶体移动到神经末梢发挥作用的机制。”“一旦这种机制被破坏,就会对神经细胞的功能和长期生存造成严重后果。”
蛋白酶体是在神经元的细胞体中产生的,需要经过长距离的运输才能到达神经元与其他细胞连接的神经末梢,在某些情况下,这个过程要超过一米。当蛋白酶体不能到达这些关键的通讯枢纽时,细胞就会陷入混乱。
斯特勒说:“这些位点上的受损蛋白质非但没有被降解,反而停留了足够长的时间,与其他结合伙伴相互作用,形成聚集体,破坏细胞功能。”随着时间的推移,这会导致神经纤维退化,最终导致细胞死亡。
当Steller和他的团队开始研究果蝇的蛋白酶体运输系统时,他们发现了一种叫做PI31的蛋白质,它在将蛋白酶体装载到细胞成分上并运送它们的过程中起着至关重要的作用。在对发育细胞的研究中,他们发现PI31增强了与细胞马达的结合并促进了蛋白酶体的运动。没有它,交通就会停止。这是在果蝇和老鼠神经元的情况,表明运输机制是普遍的许多物种。
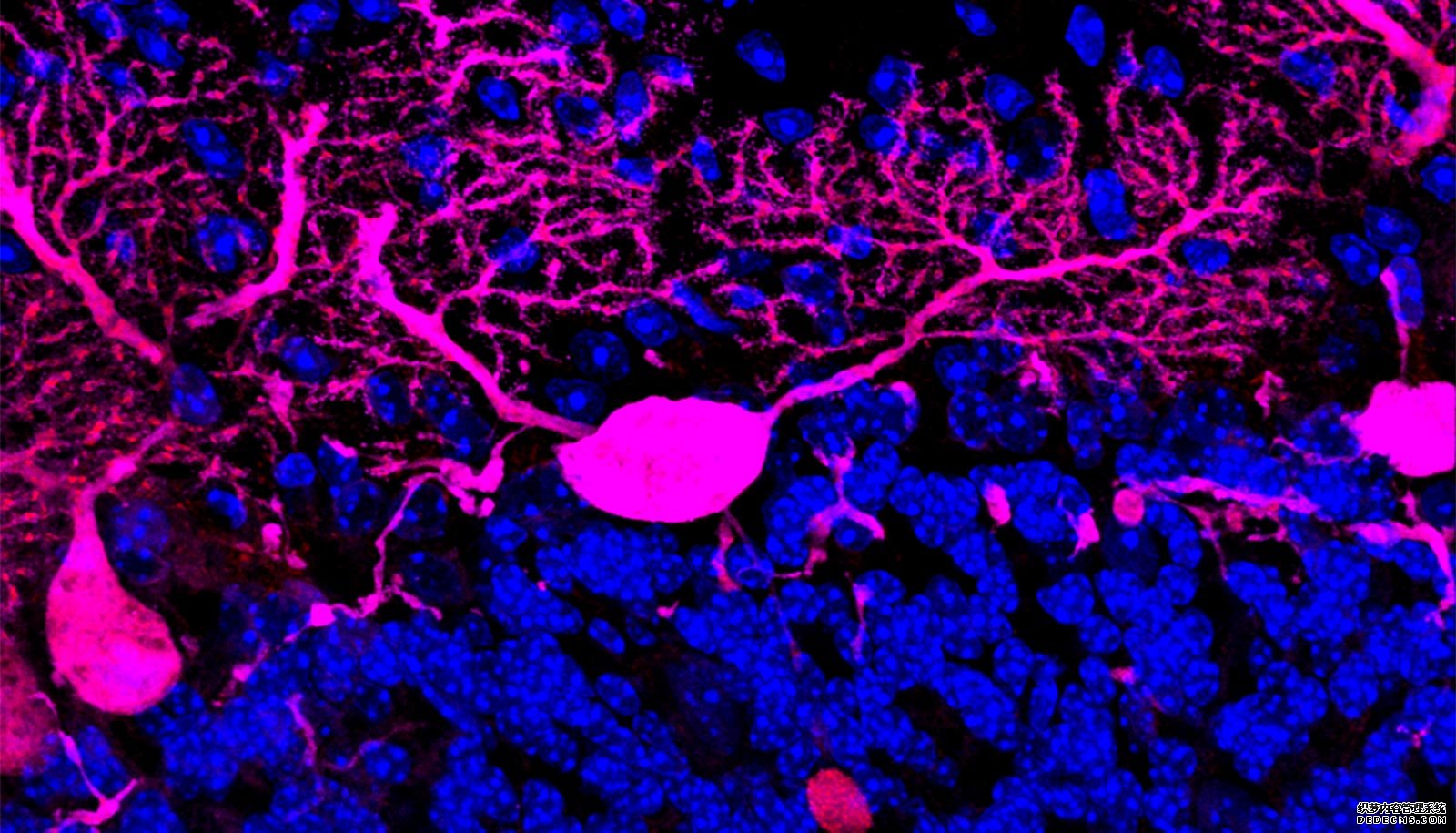
科学家们与玛丽•贝丝•哈滕(Mary Beth Hatten)的实验室合作,对PI31缺陷时的情况进行了更深入的研究,他们培育出了两组PI31基因被切断的小鼠,这两组小鼠的脑细胞都有特别长的延伸。在《美国国家科学院院刊》(Proceedings of the National Academy of Sciences)上发表的一项研究中,他们发现,如果没有PI31,蛋白酶体就无法运输,从而导致神经元分支尖端的蛋白质水平异常。缺乏pi31的神经元看起来也很奇怪,无论是就其分支还是突触而言,突触是连接两个神经元分支的结构。
“值得注意的是,随着年龄的增长,这些结构变化变得越来越严重,”Steller说。“PI31在这些神经元中的失活,让人联想到我们在某些人类神经生成疾病中看到的严重的行为和解剖学缺陷。”
还有其他原因让人怀疑实验室的发现可能有助于神经退行性疾病的治疗。例如,在一种严重的早发性帕金森病中发现了一种名为PARK15的人类基因突变,该基因对PI31的活性至关重要;PI31基因本身的突变与阿尔茨海默病有关。
Steller和他的团队现在正在研究PI31,或影响其活性的分子,是否是可行的药物靶点。PI31似乎参与了神经细胞退化的早期阶段,这一事实尤其引人注目,因为它可能意味着阻断这种蛋白的药物可能在这一过程的早期就有可能阻止脑损伤。
至于究竟是什么导致了大脑退化,Steller认为聚集物的形成可能不是直接的疾病机制,代理沐鸣好吗而是更大问题的症状。
他说:“我们的工作表明,它实际上始于蛋白酶体的局部缺陷,导致不能降解对神经功能至关重要的蛋白质。”这些未消化的蛋白质随后形成聚集物,并激活额外的损伤控制通路。但最终,这些清除系统不堪重负,导致缓慢但稳定的进展成为可检测到的疾病。”
Steller和他的同事们现在正在研究刺激将蛋白酶体运输到远端分支的途径,他们相信这项工作将对神经退行性疾病的治疗产生广泛的影响。